ซอฟต์แวร์ในฐานะเครื่องมือแพทย์: คำจำกัดความและขอบเขตของข้อบังคับ
เผยแพร่แล้ว: 2019-09-06นับตั้งแต่ 40 ปีที่ผ่านมา จำนวนนวัตกรรมทางเทคโนโลยีทั้งภายในและรอบๆ อุปกรณ์การแพทย์ได้เพิ่มขึ้นอย่างมาก โดยเฉพาะอย่างยิ่ง 20 ปีที่ผ่านมาได้เห็นการเร่งความเร็วในภาคส่วนนี้ ต้องขอบคุณ Internet of Things และการเพิ่มขึ้นของส่วนที่เกี่ยวข้องอื่นๆ เช่น การเชื่อมต่อไร้สาย คลาวด์คอมพิวติ้ง และ AI เป็นต้น ความก้าวหน้าเหล่านี้ได้เปลี่ยนแปลงกระบวนการดูแลสุขภาพ
แม้จะผ่านไป 20 ปีแล้ว เทคโนโลยีระดับแนวหน้าเหล่านี้ยังคงก่อให้เกิดการเปลี่ยนแปลงครั้งใหญ่ในกระบวนการบริหารจัดการและการส่งมอบบริการสุขภาพ
และตอนนี้ แอปพลิเคชั่นมือถือได้เข้ามามีบทบาทและกลายเป็นส่วนสำคัญของวัตถุประสงค์ทางการแพทย์และไม่ใช่ทางการแพทย์ที่มีความต้องการสูงเหล่านี้
แอพหรือซอฟต์แวร์เหล่านี้ที่เป็นอุปกรณ์ทางการแพทย์ด้วยตัวของมันเอง – ซอฟต์แวร์ตาม ขนาดตลาดอุปกรณ์ การแพทย์ ได้เติบโตขึ้นจนกลายเป็นส่วนหนึ่งในชีวิตของผู้ใช้ การใช้งานของ SamD ไม่ได้จำกัดอยู่แค่ในการวินิจฉัยเท่านั้น แต่ยังได้เข้ามามีบทบาทในกระบวนการติดตามและรักษาด้วย อันที่จริง SamD ได้นำไปสู่ วิวัฒนาการของ Healthcare 1.0 ไปสู่ Healthcare 3.0
เมื่อเห็นว่า SaMD รวม อยู่ใน การดูแลสุขภาพ ในชีวิตประจำวัน เพิ่มมากขึ้น ฟอรัมผู้กำกับดูแลอุปกรณ์ทางการแพทย์ระหว่างประเทศ (IMDRF) ซึ่งองค์การอาหารและยาแห่งสหรัฐอเมริกาเป็นสมาชิก ได้อธิบายแนวคิดและหมวดหมู่ความเสี่ยงของ SaMD โดยละเอียดสำหรับอุตสาหกรรมการพัฒนาแอปทางการแพทย์ที่จะปฏิบัติตาม ซอฟต์แวร์ของ FDA ในฐานะเครื่องมือแพทย์ได้พัฒนาและชี้แจงนโยบายตามความเสี่ยงเพื่อการสื่อสารความต้องการที่ดีขึ้น และปรับแนวทางการกำกับดูแลให้สอดคล้องกับธรรมชาติของอุปกรณ์ดิจิทัลที่กำลังพัฒนา
* SamD ไม่ใช่การปฏิบัติตามข้อกำหนดเพียงอย่างเดียวที่ผู้มีส่วนได้ส่วนเสียในอุตสาหกรรมการดูแลสุขภาพ – ผู้ประกอบการแอปพลิเคชัน mHealth และผู้ผลิตอุปกรณ์ควรปฏิบัติตาม มีการปฏิบัติตามข้อกำหนดอื่นๆ เช่น FDA, HIPAA, HL7 และ FCPA เราได้กล่าวถึงการปฏิบัติตามข้อกำหนดเหล่านี้อย่างละเอียดใน ในบทความนี้ เราจะอธิบายเกี่ยวกับ SamD ซอฟต์แวร์ที่เป็นข้อบังคับของอุปกรณ์ทางการแพทย์ และประเภทแอป mHealth และซอฟต์แวร์ทางการแพทย์ประเภทอื่นๆ ที่จัดอยู่ในประเภทซอฟต์แวร์เป็นอุปกรณ์ทางการแพทย์
สารบัญ
- ซอฟต์แวร์เป็นอุปกรณ์ทางการแพทย์คืออะไร?
- จะทราบได้อย่างไรว่าแอพมือถือของคุณเป็น SamD?
- ปัจจัยที่ต้องพิจารณาสำหรับการกำหนดลักษณะ SamD
- ตัวอย่างของซอฟต์แวร์ในฐานะอุปกรณ์ทางการแพทย์มีอะไรบ้าง?
- คุณจำแนกซอฟต์แวร์เป็นอุปกรณ์ทางการแพทย์อย่างไร?
- ผู้ผลิต Samd สามารถทำอะไรได้บ้างเพื่อให้แน่ใจว่ามีกฎระเบียบ?
- บทสรุป
- คำถามที่พบบ่อยเกี่ยวกับ SamD
ซอฟต์แวร์เป็นอุปกรณ์ทางการแพทย์คืออะไร?

คำศัพท์ – ซอฟต์แวร์ในฐานะอุปกรณ์ทางการแพทย์ หมายถึงซอฟต์แวร์ใดๆ ที่มีจุดประสงค์เพื่อการใช้งานทางการแพทย์อย่างใดอย่างหนึ่งหรือหลายอย่าง และดำเนินการตามวัตถุประสงค์เหล่านี้โดยไม่ต้องรวมเข้ากับอุปกรณ์ฮาร์ดแวร์ทางการแพทย์
นี่คือวิธีที่ IMDRAF กำหนด SamD –
'คำว่า "ซอฟต์แวร์เป็นอุปกรณ์ทางการแพทย์" (SaMD) หมายถึงซอฟต์แวร์ที่มีจุดประสงค์เพื่อใช้เพื่อวัตถุประสงค์ทางการแพทย์อย่างน้อยหนึ่งรายการซึ่งดำเนินการตามวัตถุประสงค์เหล่านี้โดยไม่ต้องเป็นส่วนหนึ่งของอุปกรณ์ฮาร์ดแวร์ทางการแพทย์
จะทราบได้อย่างไรว่าแอพมือถือของคุณเป็น Samd?
- SaMD เป็นอุปกรณ์ทางการแพทย์และรวมถึงอุปกรณ์ทางการแพทย์ในการวินิจฉัยโรคในหลอดทดลอง (IVD)
- สามารถ ทำงานบนแพลตฟอร์มการคำนวณทั่วไป (ที่ไม่ใช่ทางการแพทย์) ได้
- ซอฟต์แวร์ ไม่ เป็นไปตามคำจำกัดความของ SamD หากมีวัตถุประสงค์เพื่อขับเคลื่อนอุปกรณ์ ทางการแพทย์ที่ เป็น ฮาร์ดแวร์
- สามารถใช้กับผลิตภัณฑ์อื่นๆ เช่น อุปกรณ์ทางการ แพทย์
- อาจ มี การเชื่อมต่อกับอุปกรณ์ทางการแพทย์อื่น ๆ รวมถึงฮาร์ดแวร์อุปกรณ์การแพทย์และซอฟต์แวร์ SamD อื่น ๆ รวมถึงซอฟต์แวร์เอนกประสงค์
ปัจจัยที่ต้องพิจารณาสำหรับการกำหนดลักษณะ SamD
มีสองวิธีในการกำหนดลักษณะ SamDs:
ข้อมูลที่จัดทำโดยSaMD
- เพื่อวินิจฉัยหรือรักษาผู้ป่วย
- เพื่อแจ้งการจัดการทางคลินิก
- เพื่อขับเคลื่อนการจัดการทางคลินิก
เงื่อนไขการดูแลสุขภาพ
- ภาวะวิกฤติ
- สภาพที่ร้ายแรง
- ภาวะไม่ร้ายแรง
บนพื้นฐานของลักษณะเหล่านี้ SamDs แบ่งออกเป็นสี่ประเภท
ตัวอย่างของซอฟต์แวร์ในฐานะอุปกรณ์ทางการแพทย์มีอะไรบ้าง?
- ซอฟต์แวร์ที่เป็นอุปกรณ์ทางการแพทย์สามารถเชื่อมต่อกับอุปกรณ์ทางการแพทย์อื่นๆ รวมถึงอุปกรณ์ทางการแพทย์ที่เป็นฮาร์ดแวร์ และซอฟต์แวร์อื่นๆ ในฐานะอุปกรณ์ทางการแพทย์ เช่นเดียวกับซอฟต์แวร์ใช้งานทั่วไป ซอฟต์แวร์ที่ให้ขอบเขตจะกลายเป็นอินพุตสำหรับอุปกรณ์ฮาร์ดแวร์อื่นหรือ SamD อื่นๆ ตัวอย่างเช่น ซอฟต์แวร์ที่เป็นตัวอย่างอุปกรณ์ทางการแพทย์สามารถเป็นซอฟต์แวร์วางแผนการรักษาที่จัดเตรียมข้อมูลที่ใช้ในตัวเร่งความเร็วเชิงเส้นคือ SaMD
- ตัวอย่างเช่น ซอฟต์แวร์ที่คาดว่าจะใช้ในการวิเคราะห์สภาพโดยใช้มาตรความเร่งแบบสามแกนที่ทำงานบนโปรเซสเซอร์ที่ติดตั้งในกล้องดิจิตอลสำหรับผู้บริโภคจะถูกมองว่าเป็นซอฟต์แวร์เป็นอุปกรณ์ทางการแพทย์
- ซอฟต์แวร์ที่เชื่อมต่อกับอุปกรณ์ฮาร์ดแวร์ทางการแพทย์ แต่อุปกรณ์นั้นไม่จำเป็นต้องใช้เพื่อให้บรรลุวัตถุประสงค์ทางการแพทย์คือ ซอฟต์แวร์ที่เป็นอุปกรณ์ทางการแพทย์ ไม่ใช่อุปกรณ์เสริมของอุปกรณ์ทางการแพทย์
- ซอฟต์แวร์ SMD สามารถทำงานบนแพลตฟอร์มการคำนวณวัตถุประสงค์ทั่วไป (เช่น เหตุผลที่ไม่ใช่ทางคลินิก) ซอฟต์แวร์เหล่านี้ทำงานบนแพลตฟอร์มคอมพิวเตอร์เอนกประสงค์เหล่านี้ อาจอยู่ในอุปกรณ์ทางการแพทย์ที่เป็นฮาร์ดแวร์
หมวดหมู่ ตัวอย่างที่ชาญฉลาดของ SamD
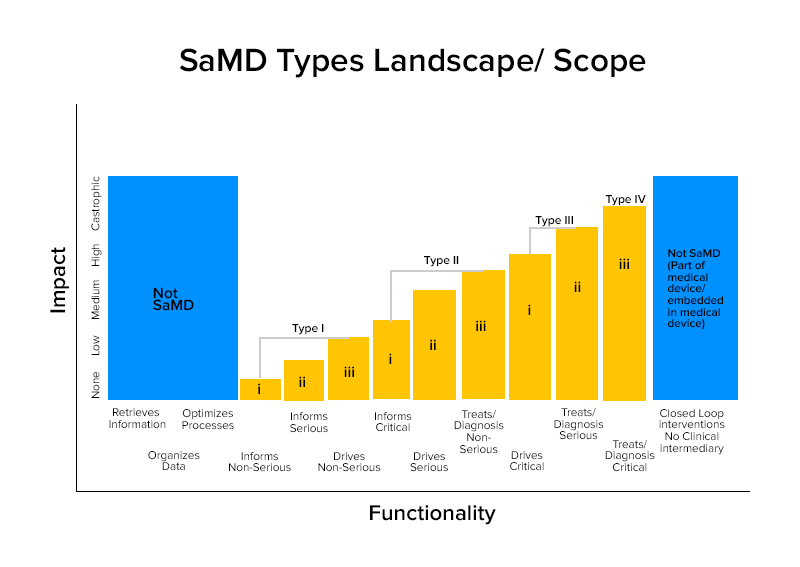
หมวดหมู่ IV:
- SamDs ซึ่งทำการวิเคราะห์ภาพเพื่อการวินิจฉัยเพื่อให้สามารถตัดสินใจในการรักษาเมื่อผู้ป่วยเป็นโรคหลอดเลือดสมองเฉียบพลัน
- SaMDs ซึ่งคำนวณขนาดเศษส่วนของแผลและ สร้าง แผนที่โครงสร้างซึ่งแสดงรูปแบบการเติบโตที่แตกต่างกันสำหรับการวินิจฉัยหรือการระบุหากรอยโรคนั้นไม่เป็นพิษเป็นภัยหรือร้ายแรง
- SaMDs รวม ข้อมูลจากการตรวจ อิมมูโน เพื่อคัดกรอง การระบาดของเชื้อโรคที่เปลี่ยนแปลงได้ซึ่งสามารถติดต่อกันได้สูง
หมวดหมู่ที่สาม:

- SamD ซึ่งใช้ ไมโครโฟน ของโทรศัพท์ เพื่อตรวจจับการหายใจขัดจังหวะระหว่างการนอนหลับ
- ใช้ สำหรับให้ข้อมูลโดยคลิกที่รูปภาพ ติดตามการเจริญเติบโต หรือข้อมูลอื่น ๆ เพื่อเสริมข้อมูลอื่น ๆ ที่ผู้ให้บริการด้านการดูแลสุขภาพใช้ในการวินิจฉัยว่ารอยโรคที่ผิวหนังไม่เป็นพิษเป็นภัยหรือไม่
หมวดหมู่ที่สอง:
- SamDs ที่วิเคราะห์อัตราการเต้นของหัวใจ
- SaMD ซึ่งใช้ข้อมูลบันทึกสุขภาพของบุคคลในการทำนายความเสี่ยงของโรคหัวใจหรือโรคหลอดเลือดสมอง และสร้างกลยุทธ์ในการป้องกัน
- SaMD ซึ่งรวมและวิเคราะห์การทดสอบหลายรายการเพื่อเสนอคำแนะนำสำหรับการวินิจฉัยในข้อบ่งชี้ทางคลินิกบางอย่าง
ประเภทที่ 1:
- ซอฟต์แวร์อุปกรณ์การแพทย์ ที่ รวบรวม ข้อมูลจากบันทึกอาการเพื่อให้ข้อมูลเพื่อวัดการเกิดโรคหอบหืด
- ซอฟต์แวร์ทางการแพทย์ อุปกรณ์ วิเคราะห์ภาพ การเคลื่อนไหวของดวงตาเพื่อเป็น แนวทางใน การวินิจฉัยโรคสายตาเอียงครั้งต่อไป
- โปรแกรม ที่ จัด เก็บ ข้อมูลความดันโลหิตในอดีตเพื่อให้ผู้ให้บริการ ด้าน สุขภาพตรวจสอบ
- ซอฟต์แวร์ ที่ใช้ข้อมูลความไวในการได้ยิน คำพูดในเสียง และการขอให้ผู้ใช้ตอบแบบสอบถามเกี่ยวกับสถานการณ์การฟังทั่วไปสำหรับการประเมินการสูญเสียการได้ยินด้วยตนเอง
คุณจำแนกซอฟต์แวร์เป็นอุปกรณ์ทางการแพทย์อย่างไร?
EU MDR ใหม่ (กฎระเบียบด้านอุปกรณ์การแพทย์ของสหภาพยุโรป) ให้คำจำกัดความ กฎ การจำแนกประเภท และความจำเป็นขั้นตอนสำหรับมาตรฐานซอฟต์แวร์อุปกรณ์การแพทย์
EU MDR Annex VIII กล่าวถึงซอฟต์แวร์ต่างๆ ว่าเป็นกฎการจำแนกประเภทอุปกรณ์ทางการแพทย์
กฎข้อที่ 11 ในภาคผนวก VIII เกี่ยวข้องกับการจำแนกประเภทของซอฟต์แวร์และกล่าวถึงการจำแนกประเภทของซอฟต์แวร์ที่ใช้โดยลำพังหรือใช้ร่วมกับเครื่องมือแพทย์โดยเฉพาะ
ซอฟต์แวร์ที่วางแผนไว้เพื่อให้ข้อมูลซึ่งใช้ในการตัดสินใจเลือกในแง่ของการวินิจฉัยหรือวัตถุประสงค์ในการรักษาโรค จัดอยู่ในประเภท IIa นอกเหนือจากหากตัวเลือกดังกล่าวมีผลกระทบที่อาจทำให้เสียชีวิตหรือสุขภาพร่างกายเสื่อมโทรมที่ไม่สามารถย้อนกลับได้ ในกรณีเช่นนี้ ภาวะดังกล่าวอยู่ในประเภท III หรือการเสื่อมสภาพอย่างร้ายแรงของภาวะสุขภาพของบุคคลหรือการแทรกแซงทางศัลยกรรม ซึ่งในกรณีนี้จัดอยู่ในประเภท IIb
ซอฟต์แวร์ที่คาดว่าจะตรวจสอบกระบวนการทางสรีรวิทยาจะมอบหมายให้เป็น Class IIa ยกเว้นในกรณีที่เสนอให้สังเกตพารามิเตอร์ทางสรีรวิทยาที่สำคัญ โดยธรรมชาติของตัวแปรต่างๆ เหล่านั้นอาจก่อให้เกิดภัยคุกคามต่อผู้ป่วยในทันที ซึ่งในกรณีนี้ ชื่อคลาส IIb ซอฟต์แวร์ที่เหลือทั้งหมดได้รับมอบหมายให้เป็น Class I
ตัวอย่างเช่น ซอฟต์แวร์ที่ใช้ในการตรวจวัดอัตราการเต้นของหัวใจหรือพารามิเตอร์ทางสรีรวิทยาอื่นๆ ระหว่างการตรวจร่างกายตามปกติจะได้รับมอบหมายให้เป็น Class IIa หากมีโอกาสใดที่การเฝ้าติดตามมุ่งเน้นไปที่พารามิเตอร์ทางสรีรวิทยาที่จำเป็น และที่ซึ่งพารามิเตอร์เหล่านั้นอาจก่อให้เกิดอันตรายต่อผู้ป่วยในทันที การจำแนกประเภทจะเพิ่มเป็นระดับ IIb
ผู้ผลิต Samd สามารถทำอะไรได้บ้างเพื่อให้แน่ใจว่ามีกฎระเบียบ?
บริษัท SaMD ควรมีระบบการจัดการคุณภาพที่ดีซึ่งรวมอยู่ในกระบวนการพัฒนาเพื่อให้มั่นใจว่าสอดคล้องกับระเบียบข้อบังคับใดๆ แพลตฟอร์ม QMS ที่เลือกควรสามารถปฏิบัติตามข้อกำหนดด้านกฎระเบียบ เช่น FDA 21 CFR Part 820 และ ISO 13485:2016
ความผิดพลาดใด ๆ ในทิศทางที่สามารถนำไปสู่ผลร้ายแรงกับใบสมัครของคุณถูกแบนเป็นเพียงจุดเปลี่ยน เมื่อสังเกตถึงความสำคัญ ขอแนะนำว่าคุณควรร่วมมือกับ บริษัทพัฒนาซอฟต์แวร์ด้านการดูแลสุขภาพ ซึ่งทำงานควบคู่ไปกับผู้ปฏิบัติงานทางการแพทย์ที่เข้าใจกฎระเบียบและการปฏิบัติตามข้อกำหนดเหล่านี้อย่างครบถ้วน
บทสรุป
บริษัทพัฒนาแอพเพื่อสุขภาพในสหรัฐอเมริกาใน ปัจจุบันกำลังพัฒนาซอฟต์แวร์เพื่อใช้กับอุปกรณ์ทางการแพทย์ หรือเป็นอุปกรณ์ทางการแพทย์แบบสแตนด์อโลน ควรตระหนักถึงการเปลี่ยนแปลงเหล่านี้ และตรวจสอบให้แน่ใจว่าได้ใช้มาตรการเพื่อให้แน่ใจว่าซอฟต์แวร์ของพวกเขาสอดคล้องกับระบอบการปกครองใหม่

คำถามที่พบบ่อยเกี่ยวกับ SamD
ถาม: ตัวอย่างซอฟต์แวร์ที่ไม่ใช่ SamD มี อะไรบ้าง
- แอพที่ฮาร์ดแวร์อุปกรณ์การแพทย์จำเป็นสำหรับการปฏิบัติหน้าที่
- แอพที่ขึ้นอยู่กับข้อมูลอุปกรณ์การแพทย์
- แอปที่ช่วยให้สามารถสื่อสารและทำให้ขั้นตอนการทำงานทางคลินิกคล่องตัวขึ้น เช่น แอปสำหรับการนัดหมาย การโทรผ่านวิดีโอหรือการโทรด้วยเสียง เป็นต้น
ตัวอย่างแอพไม่ จำกัด เฉพาะสิ่งเหล่านี้ มีแอปประเภทอื่นๆ อีกจำนวนหนึ่งที่ไม่อยู่ภายใต้คำจำกัดความของ SamD
ถาม ซอฟต์แวร์เป็นอุปกรณ์ทางการแพทย์สามารถทำอะไรได้บ้าง
แอปพลิเคชัน SaMD คือแอปพลิเคชันที่ทำหน้าที่เป็นแอปพลิเคชันด้านสุขภาพแบบสแตนด์อโลนที่ให้ผู้ใช้เข้าใจถึงสุขภาพร่างกายของตนเองโดยทำการวินิจฉัย ทำการเอ็กซ์เรย์ หรือคำนวณปริมาณอินซูลิน
ถาม IEC 62304 คืออะไร?
IEC 62304 เป็นมาตรฐานที่ระบุข้อกำหนดของวงจรชีวิตที่จำเป็นสำหรับการสร้างซอฟต์แวร์เป็นอุปกรณ์ทางการแพทย์และซอฟต์แวร์ภายในอุปกรณ์ทางการแพทย์ เมื่อใช้ร่วมกับ ISO 13485 จะมีกรอบการทำงานที่สำคัญสำหรับการออกแบบและบำรุงรักษาซอฟต์แวร์อุปกรณ์ทางการแพทย์อย่างปลอดภัย
ถาม อธิบายกระบวนการ QMS ของคุณสำหรับการพัฒนาซอฟต์แวร์อุปกรณ์ทางการแพทย์
เรามี QMS ภายในของเราเองสำหรับการทำงานกับอุปกรณ์ทางการแพทย์และลูกค้าด้านเภสัชกรรม เพื่อให้มั่นใจในคุณภาพของเราเอง เราไม่ได้รับการตรวจสอบจากลูกค้า บุคคลที่สาม หรือหน่วยงานกำกับดูแล
ขั้นที่ 1 : เริ่มโครงการ: ดำเนินการประชุมทางไกลแบบเปิดดำเนินการกับลูกค้าเพื่อ:
ทบทวนแผนโครงการและไทม์ไลน์
จบแหล่งข้อมูลที่สำคัญ
กำหนดทีมงานโครงการ
ขั้นที่ 2 : เอกสารการตรวจทาน: ประเมินและตรวจสอบเอกสารที่เกี่ยวข้องทั้งหมด รวมถึงข้อมูลผลิตภัณฑ์ที่มีอยู่ ข้อมูล/แผนที่ไม่ใช่ทางคลินิก และเอกสารกำกับดูแล แหล่งที่มาของข้อมูลนี้คือ:
ข้อมูลที่ไม่ใช่ทางคลินิก การติดต่อด้านกฎระเบียบ ข้อกำหนดทางเทคนิคของผลิตภัณฑ์ การอ้างอิงถึงอุปกรณ์เพรดิเคต การอ้างสิทธิ์ของผลิตภัณฑ์ที่เสนอ และจุดประสงค์/ข้อบ่งชี้สำหรับการใช้งาน ฯลฯ
ขั้นที่ 3 : กำหนดแนวทางการกำกับดูแล โดยใช้ข้อมูลจากส่วนด้านบน พัฒนาเส้นทางการกำกับดูแลของ FDA ที่กำหนดว่า 510(k) หรือ de novo เหมาะสมที่สุดหรือไม่ (กลยุทธ์การกำกับดูแลของ PMA ซับซ้อนกว่าและต้องใช้งบประมาณที่สูงขึ้น) เป้าหมายคือการให้คำแนะนำลูกค้าเกี่ยวกับแนวทางที่เหมาะสมที่สุดกับ FDA
